2021河北中考化学总复习之“粗盐的提纯”实验考点专项练习
2021-03-19 15:31
来源:
作者:
粗盐的提纯”在9年级化学和高中化学中均有涉及。9年级化学教学的侧重点在溶解、过滤、蒸发结晶、转移固体等操作以及产率计算方面,而高中化学教学的侧重点在可溶性杂质的去除方面。中考试题常以高中知识为命题背景,考查学生的学习能力。纵观各省、市中考试题,有关粗盐提纯实验主要有两种考法:①考查“粗盐中难溶性杂质的去除”的基本实验技能和采用过滤、蒸发等操作对混合物进行分离和除杂的方法;②考查精盐溶液中的可溶性杂质去除的实验步骤和操作流程(有时以工业流程图的形式呈现)。
1、考点梳理
粗盐中含有难溶性杂质(如泥沙)和可溶性杂质(如MgCl2、CaCl2等),粗盐的提纯包括粗提和细提。粗提时先通过过滤除去泥沙等难溶性杂质,再蒸发水分,即可获得“精盐”。细提时可通过选择合适的除杂试剂(过量)逐步除去“精盐”溶液中的可溶性杂质。同时,在后续操作中过量的除杂试剂也要完全除去。
1.1 粗盐中难溶性杂质的去除——粗提
(1)仪器:药匙、托盘天平、烧杯、玻璃棒、漏斗、铁架台(含铁圈)、蒸发皿、酒精灯、坩埚钳。
(2)步骤:溶解→过滤→蒸发结晶→产率计算。
(3)玻璃棒的4个作用。
①溶解时:搅拌,加速粗盐的溶解;②过滤时:引流,防止液体溅出;③蒸发时:防止加热时由于局部过热,造成液滴飞溅;④蒸发后:转移固体。
1.2 精盐溶液中可溶性杂质(以MgCl2、CaCl2为例)的去除——细提
(1)先向精盐溶液中加入过量的NaOH溶液、Na2CO3溶液,把Mg2+、Ca2+转化为Mg(OH)2、CaCO3沉淀。
(2)过滤除去Mg(OH)2、CaCO3沉淀。
(3)向滤液中加入适量稀盐酸除去过量的NaOH、Na2CO3,将它们转化为NaCl。
(4)加热蒸发,除去过量的HCl和溶剂水,得到NaCl晶体。
2、考查形式
2.1 考查粗盐中难溶性杂质的去除
例1(2017·江苏·连云港):海洋是巨大的资源宝库,从海洋中可以获得很多物质,连云港海水资源丰富。
通过晾晒海水得到的粗盐中含有多种可溶性杂质和不溶性杂质(泥沙等)。实验室中除去粗盐中不溶性杂质获得精盐的步骤是:溶解→过滤→蒸发→计算产率等。
(1)过滤操作中玻璃棒的末端要轻轻的斜靠在________一边。蒸发时为防止液滴飞溅,除用玻璃棒搅拌外,还可以采取的操作是________。
(2)下列操作可能导致精盐产率偏高的是________(填字母)。
a.食盐没有完全溶解即过滤
b.过滤时液面高于滤纸边缘
c.器皿上粘有的精盐没有全部转移到称量纸上
解析:本题考查粗盐提纯的步骤。涉及如下考点:粗盐提纯过滤和蒸发的注意事项;实验误差分析等知识。具体解析如下:①过滤操作中,为防止弄破滤纸,玻璃棒的末端要轻轻的斜靠在三层滤纸的一边。蒸发时为防止液滴飞溅,除用玻璃棒搅拌外,还可以采取的操作是移走酒精灯。食盐没有完全溶解即过滤,会导致部分精盐损失,从而导致制得的精盐产率偏低;过滤时液面高于滤纸边缘,会导致部分不溶于水的物质留在精盐中,从而导致制得的精盐产率偏高;器皿上粘有的精盐没有全部转移到称量纸上,会导致精盐质量偏小,从而导致制得的精盐产率低。
答案:(1)三层滤纸,移走酒精灯;(2)b。
2.2 考查精盐溶液中可溶性杂质的去除
例2(2017·浙江·绍兴):以粗盐(含杂质Na2SO4、MgCl2、CaCl2、泥沙)为原料制备精盐。
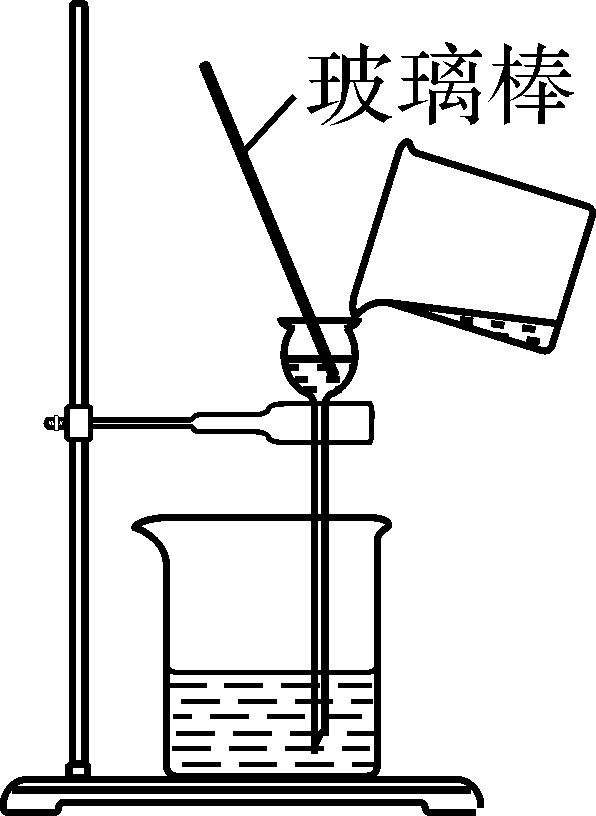
图2 实验装置
(1)加水溶解后,用如图2所示装置除去粗盐中的泥沙,玻璃棒的作用是 。
(2)为除去Na2SO4、MgCl2、CaCl2,并得到中性的食盐溶液,下列所加试剂和操作:①加过量的Na2CO3溶液,②过滤,③加过量的NaOH溶液,④加适量的稀HCl,⑤加过量的BaCl2溶液,能达到目的的顺序是________。
A.⑤③②①④
B.③⑤①④②
C.③⑤①②④
(3)用pH试纸检验溶液是否呈中性的操作是________________。
解析:本题考查粗盐中难溶性和可溶性杂质去除的一系列操作。涉及如下考点:氯化钠与粗盐提纯;碱和盐的化学性质;过滤的原理、方法及其应用;除杂的原则及注意事项;溶液的酸碱度测定。具体解析如下:(1)过滤除去粗盐中的泥沙时,玻璃棒的作用是引流。(2)欲除去溶液中的MgCl2、CaCl2、Na2SO4,则用NaOH溶液除掉MgCl2,用BaCl2溶液除掉Na2SO4,用Na2CO3溶液除掉氯化钙与多余的BaCl2,将沉淀过滤掉,用稀盐酸除去滤液中多余的NaOH和Na2CO3,所以能达到目的顺序是③⑤①②④。(3)用玻璃棒蘸取溶液滴于pH试纸上,与标准比色卡对照,从而判断溶液是否呈中性。
答案:(1)引流;(2)C;(3)用洁净的玻璃棒蘸取少量溶液,滴在pH试纸上,显示的颜色与标准比色卡对照。
3、同步检测
例3:粗食盐中混有不溶于水的泥沙,通过下述实验除去泥沙等杂质,使粗食盐得到提纯。
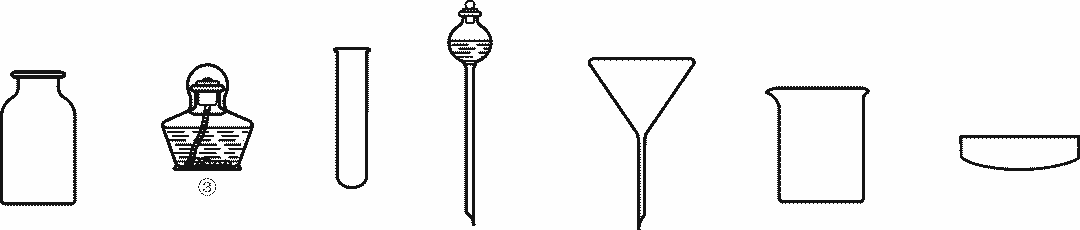
图3 实验仪器
(1)粗盐提纯实验需要下述实验仪器(见图3)中的________(填仪器名称);
(2)按要求填写粗盐提纯实验的主要操作步骤及其相关内容:
①溶解。加快溶解固体食盐的方法有(写出两种):________、________。
②________________。此步操作中玻璃棒的作用是________________________________________________________________。
③________________。
(3)某同学在同等实验条件下,所得产品的产量明显少于其他同学,请你帮他分析可能的原因是(写出两条即可):① ;② 。
答案:(1)酒精灯、漏斗、烧杯、蒸发皿。(2)①用玻璃棒搅拌、将固体研碎(或加热);②过滤、引流;③蒸发。(3)①滤液倾倒不彻底;②蒸发时有液滴飞溅(或其他合理答案)。
例4(2014·福建·漳州):某氯化钠样品中含有硫酸钠、氯化镁、氯化钙等杂质,设计了如图4所示过程除去杂质。
步骤Ⅰ:加足量的水溶解。
步骤Ⅱ:依次加入过量的BaCl2溶液、过量的NaOH溶液、过量的X溶液,充分反应后过滤。
步骤Ⅲ:加入足量的稀盐酸。
根据上述过程回答下列问题:
(1)步骤I需要用到的玻璃仪器是________和________。
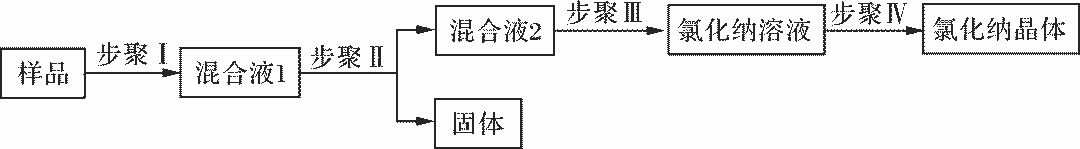
图4 除杂过程图
(2)步骤Ⅱ中加入BaCl2溶液时,发生反应的化学方程式是 。物质X是________(填化学式)溶液。
(3)步骤Ⅱ得到的固体中主要含有________(填化学式)。为了达到相同的实验目的,Ⅱ中也用过量的________(填化学式)溶液代替BaCl2和NaOH两种溶液,。
(4)步骤Ⅲ加入足量稀盐酸的目的是______,步骤Ⅳ的实验操作名称是________。
解析:(1)步骤I为溶解操作,所需要用到的玻璃仪器为烧杯和玻璃棒。(2)步骤Ⅱ中加入BaCl2溶液可将Na2SO4转化为BaSO4沉淀而除去,即Na2SO4+BaCl2=====BaSO4↓+2NaCl。而溶液中的CaCl2和过量的BaCl2等杂质可通过加入过量的Na2CO3溶液除去。(3)由于Na2SO4与BaCl2反应生成BaSO4沉淀,NaOH与MgCl2反应生成Mg(OH)2沉淀,Na2CO3与BaCl2、CaCl2反应生成BaCO3沉淀和CaCO3沉淀,故步骤Ⅱ得到的固体中主要含有BaSO4、Mg(OH)2、BaCO3和CaCO3等物质。Ba(OH)2既能与Na2SO4反应又能与MgCl2反应,故步骤Ⅱ中可用过量的Ba(OH)2溶液代替BaCl2和NaOH两种溶液。(4)步骤Ⅱ后的混合液2中含有过量的Na2CO3和NaOH,可加入足量稀盐酸,将二者完全除去。步骤Ⅳ通过蒸发结晶,除去HCl和溶剂水,即可得到氯化钠晶体。
答案:(1)烧杯;玻璃棒。(2)Na2SO4+BaCl2====BaSO4↓+2NaCl;Na2CO3。(3)BaSO4、Mg(OH)2、CaCO3、BaCO3;Ba(OH)2。(4)除去过量的Na2CO3和NaOH;蒸发结晶。

新东方石家庄学校 (微信号:helloxdf)
及时获取本地权威教育资讯,随时随地的贴身学习顾问,英语学习的好帮手、课程规划的好助手!
相关推荐
版权及免责声明
①凡本网注明"稿件来源:新东方"的所有文字、图片和音视频稿件,版权均属新东方教育科技集团(含本网和新东方网) 所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他任何方式复制、发表。已经本网协议授权的媒体、网站,在下载使用时必须注明"稿件来源:新东方",违者本网将依法追究法律责任。
② 本网未注明"稿件来源:新东方"的文/图等稿件均为转载稿,本网转载仅基于传递更多信息之目的,并不意味着赞同转载稿的观点或证实其内容的真实性。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。如擅自篡改为"稿件来源:新东方",本网将依法追究法律责任。
③ 如本网转载稿涉及版权等问题,请作者见稿后在两周内速来电与新东方网联系,电话:010-60908555。